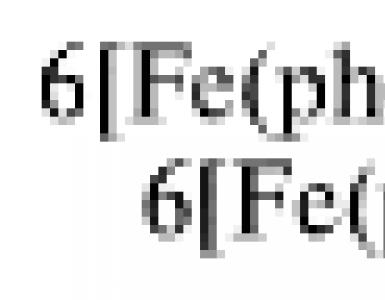Курсовая работа: Колебательные химические реакции. Исследование колебательных химических реакций Изучение механизмаколебательных реакций
КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ, сложные химические реакции, характеризующиеся колебаниями (в основном периодическими) концентраций некоторых промежуточных соединений и соответственно скоростей превращения этих соединений. Колебательные реакции наблюдаются в газовой или в жидкой фазе, а также (особенно часто) на границе раздела этих фаз с твёрдой фазой. Причиной возникновения колебаний концентраций является наличие обратных связей между отдельными стадиями сложной реакции. Колебательные реакции относят к процессам с положительной (каталитическое действие промежуточных или конечных продуктов реакции) или отрицательной (ингибирующее действие промежуточных или конечных продуктов) обратной связью.
Впервые колебательную реакцию, проявляющуюся в виде периодических вспышек света при окислении паров фосфора, наблюдал в конце 17 века Р. Бойль. В 1921 американский химик У. Брей впервые описал жидкофазную колебательную реакцию разложения пероксида водорода, катализируемую иодатами. В 1951 году российский химик Б. П. Белоусов наблюдал колебания концентраций окисленной и восстановленной форм катализатора - церия в реакции взаимодействия лимонной кислоты с броматами. Колебания можно было наблюдать визуально по изменению окраски раствора от бесцветной к жёлтой (обусловлено переходом Се 3+ → Се 4+); период колебаний 10-100 с. В 1961 году российский биофизик А. М. Жаботинский наблюдал колебания концентрации при использовании в качестве восстановителя в реакции Белоусова малоновой или яблочной кислоты. Реакция, протекающая в автоколебательном режиме каталитического окисления различных восстановителей броматами, получила название реакции Белоусова-Жаботинского (так называемый катализируемый броматный осциллятор). Известно достаточно большое количество других химических реакций, в которых наблюдаются колебательные изменения концентраций реагентов: некатализируемые броматные осцилляторы, хлоритные, иодатные, пероксидные и другие осцилляторы. Современный этап фундаментальных исследований колебательной реакции начался с работ И. Р. Пригожина с сотрудниками, в которых было показано, что в открытой системе около стационарного состояния, достаточно удалённого от положения химического равновесия, возможны колебательные химические процессы.
Кинетика колебательной реакции - бурно развивающаяся отрасль знания, возникшая на стыке химии, биологии, медицины, физики, математики. Применяется в биохимии, биофизике, учении о биоритмах, при исследовании динамики популяций, миграции организмов, в экологии, социологии (изменение численности населения, развитие экономики). Отличительной особенностью колебательной реакции является высокая чувствительность к внешним воздействиям, что открывает перспективы по созданию принципиально новых методик анализа микроколичеств различных веществ.
Лит.: Жаботинский А. М. Концентрационные автоколебания. М., 1974; Гарел Д., Гарел О. Колебательные химические реакции. М., 1986; Колебания и бегущие волны в химических системах / Под редакцией Р. Филда, М. Бургер. М., 1988; Баблоянц А. Молекулы, динамика и жизнь. М., 1990.
Министерство образования, науки, молодёжи и спорта
Теоретический лицей Петру Мовилэ
Кафедра
"Способность, труд, талант"
Курсовая работа по химии на тему:
"Колебательные химические реакции"
Выполнила: ученица 12А класса
Болюбаш Ирина
Преподаватель: Снидченко М.А.
* г. Кишинёв 2007 *
1. Введение:
а) Окислительно-восстановительные реакции
б) Колебательные химические реакции
2. История открытия колебательных реакций:
а) Исследования концентрационных колебаний до открытия
реакции Б. П. Белоусова
3. Теоретическая часть:
а) Математическая модель А. Лоткой
б) Изучение механизма колебательных реакций
4. Экспериментальная часть
5. Заключение
6. Приложение:
а) Рецепты некоторых колебательных реакций
б) Иллюстрации к проделанным опытам
7. Литература
Введение.
Химия - наука экспериментальная. И поэтому эксперимент как метод научного исследования давно и прочно занимает ведущее место среди методов естественных наук. Эксперимент - важнейший путь осуществления связи теории с практикой при обучении химии, превращения знаний в убеждения. Поэтому раскрытие познавательного значения каждого опыта - основное требование к химическому эксперименту.
Под экспериментом (от лат. «experiтeпtuт» - «испытание») понимают наблюдение исследуемого явления при определенных условиях, позволяющих следить за ходом этого явления и повторять его при соблюдении этих условий. Химический эксперимент занимает важное место в обучении химии, так как через наблюдения и опыты познаётся многообразие природы веществ, накапливаются факты для сравнений, обобщений, выводов.
Проводя опыты и наблюдая за химическими превращениями в различных условиях, мы убеждается, что сложными химическими процессами можно управлять, что в явлениях нет ничего таинственного, они подчиняются естественным законам, познание которых обеспечивает возможность широкого использования химических превращений в практической деятельности человека.
Однако результаты некоторых химических опытов неожиданны и не вписываются в традиционные представления о свойствах веществ или закономерностях протекания химических реакций. Такие химические превращения были названы, проблемным экспериментом.
Еще в пору античности философы полагали, что любое познание начинается с удивления. Удивление, вызванное новым, ведёт к развитию любознательности (чувствительности к проблемам в окружающем мире) с последующим формированием устойчивого интереса к чему-нибудь. Удивление и, следующая за ней, тяга к познанию – вот благодатная почва для изучения проблемного эксперимента, формирования диалектического и системного мышления, раскрытия творческого потенциала.
Такое же состояние может быть вызвано ярким, впечатляющим химическим экспериментом (проблемным экспериментом). В химии причинами проблемных экспериментов, чаще всего, являются окислительно-восстановительные реакции.
Окислительно-восстановительные реакции
Существуют многочисленные критерии классификации химических реакций. Один из важнейших – признак изменения степеней окисления элементов. В зависимости от того, изменяются степени окисления элементов или сохраняются, химические реакции могут быть разделены на окислительно-восстановительные и проходящие без изменения степеней окисления.
Реакции, протекающие с изменением степеней окисления элементов (окислительно-восстановительные), широко известны. Они играют большую роль в технике и природе, лежат в основе обмена веществ в живых организмах, с ними связаны процессы окисления, гниения, брожения, фотосинтеза. Процессы окисления (и восстановления) идут при сгорании топлива, коррозии металлов, электролизе, с их помощью получают металлы, аммиак, щелочи и многие другие ценные продукты. Поэтому изучение окислительно-восстановительных реакций предусмотрено школьными курсами неорганической и органической химии.
Напомним основные положения, связанные с концепцией окислительно-восстановительные реакций.
Степень окисления соответствует заряду, который возник бы на атоме данного элемента в химическом соединении, если предположить, что все электронные пары, посредством которых данный атом связан с другими, полностью смещены к атомам элементов с большей электроотрицательностью.
Окислитель – вещество, содержащее атомы или ионы, принимающие электроны: X m (окислитель) + ne - = X (m - n) , где m – степень окисления элемента в исходном веществе, n – число электронов.
Восстановитель – вещество, содержащее атомы или ионы, отдающие электроны: Y m (восстановитель) - ne - = Y (m + n) .
Окисление – процесс отдачи электронов атомом, молекулой или ионом, при этом степень окисления элемента повышается.
Восстановление - процесс приёма электронов атомом, молекулой или ионом, при этом степень окисления элемента понижается.
Окисление и восстановление – процессы сопряжённые, число электронов, отданных восстановителем в процесс его окисления, всегда равно числу электронов, принятых окислителем в процессе его восстановления.
Колебательные химические реакции
В этой курсовой работе я рассмотрю частный случай проблемного эксперимента, колебательные химические реакции. Колебательные реакции – это целый класс реакций окисления органических веществ с участием катализатора, обладающего окислительно-восстановительными свойствами. Этот процесс протекает циклично т. е. состоит из многократных повторений.
Колебательные химические реакции были открыты и научно обоснованы в 1951 г. советским учёным Борисом Петровичем Белоусовым. Б.П. Белоусов изучал окисление лимонной кислоты при её реакции с бромноватокислым натрием в растворе серной кислоты. Для усилений реакции он добавил в раствор соли церия. Церий – металл с переменной валентностью (3+ или 4+), поэтому он может быть катализатором окислительно-восстановительных превращений. Реакция сопровождается выделением пузырьков СО 2 , и поэтому кажется, что вся реакционная смесь «кипит». И вот на фоне этого кипения Б. П. Белоусов заметил удивительную вещь: цвет раствора периодически изменялся – становился то жёлтым, то бесцветным. Белоусов добавил в раствор комплекс фенантролина с двухвалентным железом (ферроин), и цвет раствора стал периодически изменяться от лилово-красного к синему и обратно.
Так была открыта реакция, ставшая знаменитой. Сейчас она известна во всём мире, её называют «реакция Белоусова-Жаботинского». А. М. Жаботинский много сделал для понимания этого удивительного феномена. С тех пор отрыто большое число аналогичных реакций.
История открытия колебательных реакций.
Открытие колебательной химической реакции И. П. Белоусов сделал при попытке создать простую химическую модель некоторых стадий системы ключевых биохимический превращений карбоновых кислот в клетке. Однако первого сообщения о его открытии напечатано не было. Рецензент химического журнала усомнился в принципиальной возможности описанной в статье реакции. Большинство химиков в те годы полагали, что чисто химических колебаний не бывает, хотя существование колебательных реакций предсказал в 1910 г. А. Лоткой на основе математической теории периодических процессов.
Вторая попытка опубликования результатов исследования была предпринята учёным в 1957 г., и опять он получил отказ, несмотря на появившиеся тогда работы бельгийского физика и физикохимика И. Р. Пригожина. В этих работах была показана возможность и вероятность колебательных химических реакций.
Лишь в 1959 г. Был напечатан краткий реферат об открытии Б. П. Белоусовым периодически действующей колебательной химической реакции в малоизвестном издании "Сборник рефератов по радиационной медицине".
А всё дело в том, что когда Б. П. Белоусов сделал своё открытие, периодические изменения концентрации реагентов казались нарушением законов термодинамики. В самом деле, как может реакция идти то в прямом, то в противоположном направлениях? Невозможно представить себе, чтобы всё огромное число молекул в сосуде было то в одном, то в другом состоянии (то все «синие», то все «красные»…).
Направление реакции определяется химическим (термодинамическим) потенциалом – реакции осуществляются в направлении более вероятных состояний, в направлении уменьшения свободной энергии системы. Когда реакция в данном направлении завершается, это значит, что её потенциал исчерпан, достигается термодинамическое равновесие, и без затраты энергии, самопроизвольно, процесс в обратную сторону пойти не может. А тут… реакция идёт то в одном, то в другом направлении.
Однако никакого нарушения законов в этой реакции не было. Происходили колебания – периодические изменения – концентраций промежуточных продуктов, а не исходных реагентов или конечных продуктов. СО 2 не превращается в этой реакции в лимонную кислоту, это в самом деле невозможно. Рецензенты не учли, что пока система далека от равновесия, в ней вполне могут происходить многие замечательные вещи. Детальные траектории системы от начального состояния к конечному могут быть очень сложными. Лишь в последние десятилетия этими проблемами стала заниматься термодинамика систем, далёких от равновесия. Эта новая наука стала основой новой науки – синергетики (теория самоорганизации).
Реакцию Белоусова, как отмечено выше, детально изучил А. М. Жаботинский и его коллеги. Они заменили лимонную кислоту малоновой. Окисление малоновой кислоты не сопровождается образованием пузырьков СО 2 , поэтому изменение окраски раствора можно без помех регистрировать фотоэлектрическими приборами. В дальнейшем оказалось, что ферроин и без церия служит катализатором этой реакции. Б. П. Белоусов уже в первых опытах заметил ещё одно замечательное свойство своей реакции: при прекращении перемешивания изменение окраски в растворе распространяется волнами. Это распространение химических колебаний в пространстве стало особенно наглядным, когда в 1970 г. А. М. Жаботинский и А. Н. Заикин налили реакционную смесь тонким слоем в чашку Петри. В чашке образуются причудливые фигуры – концентрические окружности, спирали, «вихри», распространяющиеся со скоростью около 1 мм/мин. Химические волны имеют ряд необычных свойств. Так, при столкновении они гасятся и не могут проходить сквозь друг друга.
Исследования концентрационных
колебаний до открытия реакции Б. П. Белоусовым
Но как гласит история, открытие Б. П. Белоусова было отнюдь не первым в мировой науке. Оказалось, что одна из первых публикаций по химическим колебаниям относится к 1828 г. В ней Т.Фехнер изложил результаты исследования колебаний электрохимической реакции. Наиболее интересна работа М. Розеншельда, относящаяся к 1834 г. Ее автор совершенно случайно заметил, что небольшая колба, содержащая немного фосфора, в темноте испускает довольно интенсивный свет. В самом факте свечения фосфора не было ничего удивительного, но то, что это свечение регулярно повторялось каждую седьмую секунду, было интересно. Сорок лет спустя эти эксперименты с «мерцающей колбой» продолжил француз М.Жубер (1874). Ему удалось в пробирке наблюдать периодическое образование «светящихся облаков». Еще через двадцать лет также немецкий ученый А.Центнершвер исследовал влияние давления воздуха на периодические вспышки фосфора. В его экспериментах период вспышек начинался с 20 с и уменьшался с понижением давления.
Особенно яркая страница в истории химических колебаний связана с так называемыми кольцами Лизеганга. В 1896 г. немецкий химик Р.Лизеганг, экспериментируя с фотохимикатами, обнаружил, что если капнуть ляписом на стеклянную пластину, покрытую желатиной, содержащей хромпик, то продукт реакции, выпадая в осадок, располагается на пластинке концентрическими окружностями. Лизеганг увлекся этим явлением и почти полвека занимался его исследованием. Нашлось и практическое его применение. В прикладном искусстве кольца Лизеганга использовали для украшения различных изделий с имитацией яшмы, малахита, агата и т. п. Сам Лизеганг предложил технологию изготовления искусственного жемчуга.
Перечень подобных примеров можно продолжить. Вслед за указанными были открыты колебательные реакции на границе раздела двух фаз. Из них наиболее известны реакции на границе металл–раствор, получившие специфические названия – «железный нерв» и «ртутное сердце». Первая из них – реакция растворения железа (проволоки) в азотной кислоте – получила свое название из-за внешнего сходства с динамикой возбужденного нерва, замеченного В.Ф.Оствальдом. Вторая, вернее один из ее вариантов, – реакция разложения Н 2 О 2 на поверхности металлической ртути. В реакции происходит периодическое образование и растворение пленки оксида на поверхности ртути. Колебания поверхностного натяжения ртути обусловливают ритмические пульсации капли, напоминающие биение сердца. Но все эти реакции не привлекали особенного внимания химиков, поскольку представления о ходе химической реакции были еще достаточно смутными.
Лишь во второй половине XIX в. возникли термодинамика и химическая кинетика, положившие начало специфическому интересу к колебательнымреакциям и методам их анализа.
Математическая модель А. Лоткой
Математическая теория колебаний в системах, аналогичных химическим реакциям, была опубликована еще в 1910 г. А. Лоткой – он написал систему дифференциальных уравнений, из которой следовала возможность периодических режимов. Лотка рассматривал взаимодействие «жертв», например травоядных животных, и поедающих их «хищников» (X и Y). Хищники поедают жертв и размножаются – концентрация Y растёт, но до некоторого предела, когда численность жертв резко уменьшается, и хищники умирают от голода – концентрация Y уменьшается. Тогда уцелевшие жертвы начинают размножаться – концентрация X растёт. Уцелевшие хищники вслед за этим также размножаются, концентрация Y снова растёт, и так далее многократно. Наблюдаются периодические колебания концентрации реагентов. Ясно, что условием таких незатухающих (длительное время) колебаний является изобилие травы – пищи жертв. Уравнения Лотки усовершенствовал В. Вольтерра. А современную теорию колебаний разработали российские физики Л. И. Мандельштамм, А. А. Андронов, А. А. Витт, С. Э. Хайкин, Д. А. Франк-Каменецкий. Так что для физиков и математиков открытие Белоусова не было таким удивительным.
Изучение механизма колебательных реакций.
Детальный механизм реакции Белоусова всё ещё известен не полностью. В первых работах казалось, что число промежуточных продуктов невелико. Для объяснения природы колебаний было достаточно представить себе, как сначала из малоновой кислоты образуется броммалоновая кислота, и при дальнейшей реакции с ней KВrO 3 превращается в KBr. Анион Br -- тормозит дальнейшее окисление броммалоновой кислоты, и накапливается окисленная форма катализатора (четырёхвалентного церия или трёхвалентного железа в комплексе с фенантролином). В результате прекращается накопление Br -- , и окисление броммалоновой кислоты возобновляется... Теперь ясно, что такой механизм далеко не полон. Число промежуточных продуктов достигло четырёх десятков, и изучение продолжается.
В 1972 г. Р. Нойес и сотрудники показали, что реакция Белоусова- Жаботинского – итог, по крайней мере, десяти реакций, которые можно объединить в три группы – А, Б и В.
Сначала (группа реакций А) бромат-ион взаимодействует с бромид-ионом в присутствии Н + с образованием бромистой и гипобромистой кислот:
BrO -3 + Br -- + 2H + = HBrO 2 + HOBr ( А 1)
гипобромистую кислоту:
HBrO 2 + Br -- + H + = 2HOBr ( А 2)
Гипобромная кислота, в свою очередь, реагирует с бромид-ионом, образуя свободный бром:
HOBr + Br -- + H + = Br 2 + H 2 O ( А 3)
Малоновая кислота бромируется свободным бромом:
Br 2 + CH 2 (COOH) 2 = BrCH(COOH) 2 + Br -- + H + ( А 4)
В результате всех этих реакций малоновая кислота бромируется свободным бромом:
BrO -3 + 2Br -- + 3CH 2 (COOH) 2 + 3H + = 3BrCH(COOH) 2 + 3H 2 O ( А )
Химический смысл этой группы реакций двойной: уничтожение бромид-иона и синтез броммалоновой кислоты.
Реакции группы Б возможны лишь при отсутствии (малой концентрации) бромид-иона. При взаимодействии бромат-иона с бромистой кислотой образуется радикал BrO 2 .
BrO -3 + HBrO 2 + H + > 2BrO 2 + H 2 O ( Б 1)
BrO 2 реагирует с церием (III), окисляя его до церия (IV), а сам восстанавливается до бромистой кислоты:
BrO 2 + Ce 3+ + H + > HВrO 2 + Ce 4+ ( Б 2)
Бромистая кислота распадается на бромат-ион и гипобромистую кислоту:
2HBrO 2 > BrO -3 +HOBr + H + ( Б 3)
Гипобромистая кислота бромирует малоновую кислоту:
HOBr + CH 2 (COOH) 2 > BrCH(COOH) 2 + H 2 O ( Б 4)
В итоге реакций группы Б образуется броммалоновая кислота и четырехвалентный церий.
Колебания концентраций основных компонентов реакции: бромистой кислоты и феррина – в фазовом пространстве представляются в виде замкнутой линии (предельного цикла).
BrO -3 + 4Ce 3+ + CH 2 (COOH) 2 + 5H + > BrCH(COOH) 2 + 4Ce 4+ + 3H 2 O ( Б )
Образовавшийся в этих реакциях церий (IV) (реакции группы В):
6Ce 4+ + CH 2 (COOH) 2 + 2H 2 O > 6Ce 3+ + HCOOH + 2CO 2 +6H + ( В 1)
4Ce 4+ + BrCH(COOH) 2 + 2H 2 O > Br -- + 4Ce 3+ + HCOOH + 2CO 2 + 5H + ( В 2)
Химический смысл этой группы реакций: образование бромид-иона, идущее тем интенсивнее, чем выше концентрация броммалоновой кислоты. Увеличение концентрации бромид-иона приводит к прекращению (резкому замедлению) окисления церия (III) в церий (IV). В исследованиях последнего времени церий обычно заменяют ферроином.
Из этой (неполной) последовательности этапов реакции Белоусова-Жаботинского видно, сколь сложна эта система. Так, достаточно учитывать изменение концентрации всего трех основных промежуточных компонентов реакции HВrO 2 (бромистой кислоты), Br -- и ферроина (или церия).
Первый шаг в реакции – в результате автокаталитической реакции образуется бромистая кислота (быстрый, подобный взрыву процесс), ферроин трансформируется в ферриин (окисленную форму ферроина).
Второй шаг – в результате взаимодействия с органическим компонентом феррин начинает медленно трансформироваться обратно в ферроин, и одновременно начинает образовываться бромид-ион.
Третий шаг – бромид-ион является эффективным ингибитором автокаталитической реакции (1-й шаг). Как следствие, прекращается образование бромистой кислоты, и она быстро распадается.
Четвертый шаг – процесс распада ферриина, начатый на 2-м шаге, завершается; бромид-ион удаляется из системы. В результате система возвращается к состоянию, в котором находилась до 1-го шага, и процесс повторяется периодически. Существует несколько математических моделей (систем дифференциальных уравнений), описывающих эту реакцию, колебания концентрации ее реагентов и закономерности распространения концентрационных волн.
Экспериментальная часть:
Реакция взаимодействия лимонной кислоты с броматом калия:
Реактивы:
1. K M nO 4 (перманганат калия).
2. KВrO 3 (калий бромноватокислый или бромат калия).
3. H 2 SO 4 (концентрированная).
4. Лимонная кислота.
5. Дистиллированная вода.
Ход работы: Навеску лимонной кислоты – 2 г растворили в 6 мл H 2 O. В полученный раствор добавили навеску калия бромноватокислого - 0,2 г и долили 0,7 мл концентрированной серной кислоты. Затем внесли 0,04 г перманганата калия и довели объем полученного раствора до 10 мл дистиллированной водой. Тщательно перемешали до полного растворения реактивов.
Наблюдения: Сразу после добавления KMnO 4 раствор приобрёл фиолетовую окраску и начал «кипеть». Через 25 с, при бурном кипении, цвет раствора стал меняться на коричневый. С течением реакции раствор постепенно светлеет - вплоть до светло-желтого цвета. Через 3 мин 45 с начинается резкое потемнение раствора (похоже на диффузию жидкости высокой плотности), и через 40 с раствор снова становится полностью коричневым. Далее все повторяется с периодом 4,5 мин – 5 мин. Через довольно большой промежуток времени реакция начинает замедляться, затем и прекращается вовсе (раствор жёлтого цвета).
Колебательные окислительно-восстановительные реакции:
Реактивы:
1. FeSO 4 . 7H 2 O кристаллический гептагидрат сульфата железа(II) или
Fe(NH 4) 2 (SO 4) 2 . 6H 2 O (соль Мора) гексагидрат сульфата диаммония-
железа(II)
2. Ce(NO 3) 3 . 6H 2 O гексагидрат нитрата церия(III)
3. KBr водный раствор бромида калия (2 моль/л, или 12 г на 50 мл воды)
4. KBrO 3 насыщенный раствор бромата калия (около 10 г на 100 мл воды)
5. H 2 SO 4 концентрированная серная кислота
6. CH 2 (COOH) 2 водный раствор малоновой кислоты (5 моль/л, или 52 г в
100 мл воды)
7. C 12 H 8 N 2 (phen) о-фенантролин
8. дистиллированная вода
Посуда и приборы: Полилюкс с экраном, стеклянная пластинка размером 25Χ25 см, чашка Петри, мерная колба емкостью 100 мл, колба Эрленмейера емкостью 250 мл с пришлифованной пробкой, шесть пипеток, бюретка, стеклянная палочка, промывалка, фильтровальная бумага.
Описание опыта: Для демонстрации эксперимента предварительно готовят растворы А и Б.
Раствор А – раствор ферроина – комплекса железа(II) с о-фенантролином (phen). В мерную колбу емкостью 100 мл вносят 0,70 г гептагидрат сульфата железа(II) (или 0,99 г соли Мора) и 1,49 г о-фенантролина, доводят объем раствора водой до метки и перемешивают. Раствор приобретает красный цвет за счет образования фенантролинового комплекса железа(II):
Fe 2+ + 3 phen = 2+
Раствор Б – раствор броммалоновой кислоты (готовится непосредственно перед демонстрацией). В коническую колбу с пришлифованной пробкой вводят 3,3 мл раствора бромида калия, 5 мл раствора малоновой кислоты и 5 мл концентрированной серной кислоты. Полученный раствор титруют из бюретки насыщенным раствором бромата калия при перемешивании после добавления каждой порции титранта, добиваясь исчезновения коричневой окраски за счет выделения брома в параллельно протекающей реакции конмутации:
BrO 3 – + 5Br – + 6H + = 3Br 2 + 3H 2 O
3Br 2 + 2CH 2 (COOH) 2 + 2H 2 O = BrCH(COOH) 2 + HCOOH + CO 2 + 5HBr
Общий объем раствора бромата калия, пошедшего на титрование, должен составлять около 7,5 мл. Образующаяся броммалоновая кислота неустойчива, однако некоторое время ее можно хранить при температуре 510 0 С.
Для непосредственной демонстрации опыта на стеклянную пластинку, закрывающую световое окно полилюкса, ставят чашку Петри, в которую последовательно вносят с помощью пипеток 10 мл насыщенного раствора бромата калия, 4 мл раствора броммалоновой кислоты и 1,5 мл раствора ферроина. В течение нескольких минут на красном фоне появляются голубые пятнышки за счет образование фенантролинового комплекса железа(III) 3+ в результате окисления соответствующего комплекса железа(II):
6 2+ + 6H 3 O + + BrO 3 – = 6 3+ + 9H 2 O + Br –
Этот процесс является самоускоряющимся. Образующийся комплекс 3+ окисляет броммалоновую кислоту с образованием бромид-ионов:
4 3+ + BrCH(COOH) 2 + 7H 2 O =
= 2CO 2 + 5H 3 O + + Br – + HCOOH + 4 2+
Выделяющиеся бромид-ионы являются ингибиторами реакции окисления комплексов железа(II) бромат-ионами. Только когда концентрация комплексных ионов 2+ становится достаточно высокой, ингибирующая активность бромид-ионов преодолевается, и раствор становится голубым за счет образования комплекса железа(III). Процесс повторяется снова и снова, поэтому и окраска раствора периодически изменяется из голубой в розовую, или наоборот. Изменение окраски начинается с появлением на розовом фоне голубых пятнышек, от которых во все стороны расходятся концентрические волны окраски. С течением времени скорость изменения окраски уменьшается и, в конце концов, процесс затухает. При этом на экране можно наблюдать появление “черных точек” проекций пузырьков выделяющегося диоксида углерода.
Диапазон окрасок можно расширить, если добавить в чашку Петри несколько кристаллов гексагидрата нитрата церия(III) Ce(NO 3) 3 . 6H 2 O. Тогда, помимо голубой и розовой окраски, можно наблюдать желтое (за счет образования соединений церия(IV)) или зеленое окрашивание (вследствие нало наложения желтого и голубого цвета):
6Ce 3+ + BrO 3 – + 15H 2 O = 6 2+ + Br – + 6H 3 O +
4 2+ + BrCH(COOH) 2 + 3H 3 O + =
= 2CO 2 + Br – + HCOOH + 4Ce 3+ + 9H 2 O
При нагревании скорость реакций возрастает, а смена окрасок убыстряется.
Примечание. Фенантролин представляет собой гетероциклическое соединение с двумя атомами азота, обладающими неподелёнными парами электронов и способными к координации. В комплексных соединениях с железом о -фенантролин играет роль бидентатного лиганда и образует прочные комплексы хелатного типа.
Заключение.
К настоящему времени реакция Белоусова–Жаботинского заняла достойное место в мировой науке. Каждый год в мире проводится по нескольку международных конференций по динамике нелинейных химических систем, а слова «BZ-reaction» (сокращение: реакции Белоусова-Жаботинского) звучат на десятках других конференций, посвященных проблемам физике, химии, биологии.
Изучение реакции Белоусова-Жаботинского, как я убедилась, имеет огромное значение, ведь она нашла применение в различных областях науки и техники. Эта реакция используется как модель для исследования грозного нарушения работы сердца – аритмии и фибрилляций. А в недавнее время были начаты эксперименты со светочувствительной модификацией этой реакции, когда динамика в этой системе зависит от интенсивности света. Оказалось, что такую реакцию можно использовать как вычислительную машину для хранения и обработки изображения. Светочувствительная модификация реакции Белоусова-Жаботинского может служить прототипом вычислительного комплекса, который возможно, придет на смену ЭВМ.
С другой стороны, колебательные химические реакции являются ярким примером самоорганизации в неживой природе, и в этом смысле имеется не только естественно-научное, но и философское значение. Фундаментальные изменения в естествознании, породившие так называемую теорию самоорганизации, обусловлены в значительной степени начальным импульсом, приданным ей российскими учеными на рубеже 1950–1960-х гг., когда Белоусов открыл окислительно-восстановительную химическую реакцию. При этом были обнаружены поразительные аналогии, оказалось, что многие природные явления, начиная от образования галактик до смерчей, циклонов и игры света на отражающих поверхностях, по сути дела, – процессы самоорганизации. Они могут иметь самую различную природу: химическую, механическую, оптическую, электрическую и др.
Так, все больший удельный вес приобретают исследования прикладной направленности, например, в области моделирования альтернативных средств обработки информации (в частности, анализ сложных мозаик с градацией яркости объектов). Еще одним новым направлением прикладных исследований является изучение особенностей полимеризации в БЖ-системе или сходных с ней.
Сложной пространственно-временной организации, проявляемой БЖ-системой в отсутствие перемешивания, со временем нашлись аналогии в природе, в биологических системах (например: периодические процессы клеточного метаболизма, волны активности в сердечной ткани и в тканях головного мозга, процессы, происходящие на уровне не экологических систем), в новой ее области – синергетики (теории самоорганизации), а также экспериментальные работы инициировали развитие современной теории динамических систем. Хотя в настоящее время многое в таких реакциях уже понятно, однако причины, вызывающие колебательные химические процессы, остаются до конца невыясненными.
В настоящее время кинетика колебательных реакций – бурно развивающаяся отрасль знаний, возникшая на стыке химии, биологии, медицины, физики, математики. Мне было очень интересно познакомиться со столь необычными и на первый взгляд невозможными свойствами живой материи. Но ещё больше меня поразило, что такое невероятное по своей значимости, впечатляющее открытие долгие годы не воспринималось другими, и просто не было понято великими умами того времени. Это открытие прошло свой тернистый путь, и, в конце концов, заняло достойное место в мировой науке. А сама возможность такой реакции ещё раз доказывает, что в нашем мире существует ещё очень много неизведанного и неизученного.
Приложение.
Рецепты некоторых колебательных реакций
Рецепт 1: Необходимо приготовить растворы перечисленных далее веществ из расчета их конечных концентраций: малоновая кислота 0,2 М; бромат натрия 0,3 М; серная кислота 0,3 М; ферроин 0,005 М. Ферроин можно заменить сульфатом двухвалентного марганца или трехвалентного церия, но при этом интенсивность окраски будет существенно слабее. Около 5 мл раствора всех компонентов нужно налить в чашку Петри так, чтобы толщина слоя жидкости была 0,5-1 мм. Через 3-8 мин (переходный период) можно наблюдать колебания и химические волны.
Рецепт 2: В плоскую прозрачную кювету слоями (1 мл) налить следующие растворы:
- KВrO 3 (0,2 моль/л)
- малоновую кислоту (0,3 моль/л)
- ферроин (0,003 моль/л)
- H 2 SO 4 (0,3 моль/л)
Кювету поставить на лист белой бумаги. Темп реакции можно изменить, добавляя щелочь или кислоту.
Рецепт 3: Необходимы растворы:
- лимонной кислоты (40 г в 160 мл H 2 O)
- H 2 SO 4 (1:3).
А также навески:
- KBrO 3 (16 г)
- Ce 2 (SO 4) 3 (3-3,5 г)
Раствор лимонной кислоты нагреть до 40°-50° С, затем высыпать навеску KВrO 3 . Стакан поставить на лист белой бумаги и внести навеску Ce 2 (SO 4) 3 и несколько мл H 2 SO 4 . Сразу начинает происходить чередование цветов: желтый > бесцветный > желтый, с периодом 1-2 мин.
Рецепт 4: Необходимы растворы:
- H 2 O 2 (50 мл 30%)
- KIO 3 (7,17 г в 50мл H 2 O)
- HСlO 4 (30 мл разбавленного раствора)
- малоновая кислота (3 г в 50 мл H 2 O). И навески:
- MnSO 4 (1г) и немного крахмала.
Все слить в один стакан (200-250 мл), добавить навески, размешать стеклянной палочкой. Происходит чередование цвета: бесцветный > жёлтый > голубой.
Список литературы.
1. Алиев Р. , Шноль С. Э. «Колебательные химические реакции». Кинетика и катализ. 1998. № 3. С. 130-133.
2. Шноль С. Э. Знание – Сила. 1994. № 3. С. 62-71.
3. Жаботинский А. М. Концентрационные автоколебания. М.: Наука, 1974.
4. Гарел Д., Гарел О. Колебательные химические реакции / Пер. с англ. М.:
5. Дубнищева Т. Я. Концепции современного естествознания. Новоси-
бирск: ЮКЭА, 1997, С. 683 – 697.
6. Концепции современного естествознания. Под ред. В. Н. Лавриненко,
В. П. Ратникова, М.: ЮНИТИ-ДАНА, 1999, С. 78 - 87.
7. Вавилин Б.В. "Автоколебания в жидкофазных химических системах".
Природа, 2000, № 5, С. 19 – 25.
КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ – класс окислительно-восстановительных периодических реакций. Механизм реакции напоминает работу устройства со сдерживающей защелкой. Впервые такие реакции были обнаружены в 1951 московским химиком Б.П.Белоусовым.
Колебательные реакции протекают с участием катализатора (впервые это было обнаружено в процессе реакции при наличии ионов церия) и состоят, как правило, из двух стадий.
Необходимые условия, обеспечивающие возможность протекания таких реакций:
а) скорость первой стадии должна заметно превышать скорость второй стадии;
б) на второй стадии должно возникать соединение, тормозящее протекание первой стадии (его называют ингибитором).
Подобную реакцию можно наблюдать при смешении водных растворов соли церия(III) (например, сульфат церия), бромата калия KBrO 3 и броммалоновой кислоты HO(O)C – CH(Br) – C(O)OH. Реакционную массу подкисляют серной кислотой.
На первой стадии ион трехвалентного церия (возникший при диссоциации соли церия) восстанавливается бромат-анионом (его поставляет бромат калия). При этом ион Се(III) окисляется до Се(IV), что внешне заметно по изменению окраски реакционного раствора – ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску.
10Ce 3+ + 2BrO 3 – + 12H + = 10Ce 4+ + Br 2 + 6H 2 O (I)
На следующей стадии образовавшийся ион Се(IV) реагирует с броммалоновой кислотой, окисляя ее:
4Ce 4+ + HO(O)C – CH(Br) – C(O)OH + 2H 2 O =
4Ce 3+ + HC(O)OH + 2CO 2 + 5H + + Br - (II)
При этом церий вновь становится ионом Се(III) и может вновь участвовать в реакции I. В данном случае он играет роль типичного катализатора, участвует в реакции, но при этом не расходуется, тем не менее, без него реакция не пойдет. Расходуются в процессе реакции бромат калия и броммалоновая кислота, церий лишь передает электроны от одного реагента к другому (исходные реагенты отмечены черным цветом, а продукты реакции – красным):
Своеобразие этой реакции состоит в том, что на стадии II в качестве побочного продукта возникает бром-анион Br – . Он ингибирует, то есть тормозит стадию I, а на стадию II влияния не оказывает. В результате в реакционной системе накапливаются продукты стадии II, прежде всего, ионы Се 3+ . В определенный момент, когда этих ионов накапливается очень много, ионы брома уже не могут далее тормозить стадию I, и она проходит с высокой скоростью. В системе вновь появляются ионы Се(IV), которые далее участвуют в медленной стадии II. Таким образом, ионы брома исполняют роль спускового крючка, не позволяющего до определенного момента стартовать первой стадии. Внешне это выглядит следующим образом (ионы Се(III) в водном растворе бесцветны, а Се(IV) имеют желтую окраску): реакционная масса мгновенно желтеет, а затем медленно обесцвечивается (рис. 4, стакан № 1). Цвет меняется приблизительно каждые полторы минуты, интервал времени сохраняется неизменным в течение нескольких часов. Если постепенно добавлять расходующиеся реагенты, то такие «химические часы» будут работать очень долго. При повышении температуры временнóй цикл колебательной реакции сокращается.
Существуют другие примеры колебательных реакций. В описанной выше системе ионы церия можно заменить ионами железа. Для этого используют комплекс сульфата Fe(II) с тремя молекулами фенантролина, который в водном растворе окрашен в красный цвет (этот комплекс широко используют для количественного определения железа):
Аналогичный комплекс Fe(III), появляющийся в результате окисления, окрашен в голубой цвет, в процессе реакции голубой цвет мгновенно становится красным, который вновь постепенно переходит в голубой (рис. 4, стакан № 2).
Если заменить броммалоновую кислоту лимонной [НОС(О)СН 2 ] 2 С(ОН)С(О)ОН, то в присутствии каталитических количеств солей марганца возникает система, в которой цвет пульсирует каждые две минуты (рис. 4, стакан № 3). Щавелево-уксусная кислота НОС(О)СН 2 С(О)С(О)ОН с солями церия отсчитывает шестисекундные интервалы (стакан № 4). Интервалы времени на анимированном рисунке показаны условно, самый большой интервал смены цвета в стакане № 3, самый малый – в стакане № 4
Вскоре после открытия таких реакций удалось установить, что подобные процессы достаточно распространены. В результате была разработана общая теория колебательных процессов, к которым относят некоторые газофазные реакции (например, окисление углеводородов), гетерофазное окисление монооксида углерода, водорода, аммиака, этилена на металлических катализаторах, ряд полимеризационных процессов. Колебательные реакции определяют протекание некоторых важнейших биологических процессов: генерации нервных импульсов и механизма мышечного сокращения.
Михаил Левицкий
Исследования концентрационных колебаний до открытия реакции Белоусовым
Оказалось, что одна из первых публикаций по химическим колебаниям относится к 1828 г. В ней Т. Фехнер изложил результаты исследования колебаний электрохимической реакции. В 1833 г. В. Гершель публикует подобное исследование колебаний каталитической гетерогенной реакции. Наиболее интересна работа М. Розеншельда, относящаяся к 1834 г. Ее автор совершенно случайно заметил, что небольшая колба, содержащая немного фосфора, в темноте испускает довольно интенсивный свет. В самом факте свечения фосфора не было ничего удивительного, но то, что это свечение регулярно повторялось каждую седьмую секунду, было интересно. В публикации Розеншельда приводится детальное исследование мерцаний колбы. Сорок лет спустя эти эксперименты с "мерцающей колбой" продолжил француз М. Жубер (1874). Ему удалось в пробирке наблюдать периодическое образование "светящихся облаков". Еще через двадцать лет также немецкий ученый А. Центнершвер исследовал влияние давления воздуха на периодические вспышки фосфора. В его экспериментах период вспышек начинался с 20 сек. и уменьшался с понижением давления. В то же время в Англии химики Т. Торп и А. Таттон наблюдали в запаянном стеклянном сосуде периодические вспышки реакции окисления триоксида фосфора.
Особенно яркая страница в истории химических колебаний связана с так называемыми кольцами Лизеганга. В 1896 г. немецкий химик Р. Лизеганг, экспериментируя с фотохимикатами, обнаружил, что если капнуть ляписом на стеклянную пластину, покрытую желатиной, содержащей хромпик, то продукт реакции, выпадая в осадок, располагается на пластинке концентрическими окружностями. Лизеганг увлекся этим явлением и почти полвека занимался его исследованием. Нашлось и практическое его применение. В прикладном искусстве кольца Лизеганга использовали для украшения различных изделий с имитацией яшмы, малахита, агата и т. п. Сам Лизеганг предложил технологию изготовления искусственного жемчуга. И все-таки открытие Лизеганга, имевшее большой резонанс в научных химических кругах, не было первым. И до него изучали химические волны, а в 1855 г. вышла книга Ф. Рунге, в которой были собраны многочисленные примеры таких экспериментов.
Перечень подобных примеров можно продолжить. Вслед за указанными были открыты колебательные реакции на границе раздела двух фаз. Из них наиболее известны реакции на границе металл-раствор, получившие специфические названия - "железный нерв" и "ртутное сердце". Первая из них - реакция растворения железа (проволоки) в азотной кислоте - получила свое название из-за внешнего сходства с динамикой возбужденного нерва, замеченного В.Ф. Оствальдом. Вторая, вернее один из ее вариантов, - реакция разложения Н 2 О 2 на поверхности металлической ртути. В реакции происходит периодическое образование и растворение пленки оксида на поверхности ртути. Колебания поверхностного натяжения ртути обусловливают ритмические пульсации капли, напоминающие биение сердца. Но все эти реакции не привлекали особенного внимания химиков, поскольку представления о ходе химической реакции были еще достаточно смутными.
Лишь во второй половине XIX в. возникли термодинамика и химическая кинетика, положившие начало специфическому интересу к колебательным реакциям и методам их анализа. И в то же время именно развитие равновесной термодинамики послужило на первых порах тормозом при изучении подобных процессов. Дело, видимо, было в "инерции предыдущего знания". По словам профессора Шноля, "не мог образованный человек представить себе в беспорядочном тепловом движении огромного числа молекул макроскопическую упорядоченность: все молекулы то в одном, то в другом состоянии! Будто признать существование вечного двигателя. Этого быть не может. И в самом деле не может этого быть. Не может быть вблизи состояния равновесия, а только его и рассматривала термодинамика тех лет. Однако никаких ограничений на сложные, в том числе колебательные, режимы нет для неравновесных химических систем, когда реакции еще не завершились, и концентрации реагентов не достигли равновесного уровня. Но это обстоятельство ускользало от внимания химиков… Потребовалось чрезвычайное интеллектуальное напряжение, чтобы вырваться из "железных оков полного знания" и исследовать поведение систем вдали от равновесия".
Тем не менее уже в 1910 г. итальянец А. Лотка на основе анализа системы дифференциальных уравнений предсказал возможность колебаний в химических системах. Однако первые математические модели соответствовали только затухающим колебаниям. Лишь через 10 лет Лотка предложил систему с двумя последующими автокаталитическими реакциями, и в этой модели колебания уже могли быть незатухающими.
Однако позиции физиков и химиков здесь разошлись. Одно из наиболее ярких достижений физики и математики XX в. - создание теории колебаний. Большие, общепризнанные заслуги принадлежат здесь советским физикам. В 1928 г. аспирант А.А. Андронов, будущий академик, выступил на съезде физиков с докладом "Предельные циклы Пуанкаре и теория автоколебаний".
В начале 1930-х гг. в Институте химической физики АН СССР были обнаружены колебания свечения в "холодных пламенах", аналогичные колебательной люминесценции паров фосфора, которые заинтересовали известного физика Д.А. Франк-Каменецкого, объяснившего эти колебания на основании кинетической модели Лотки. А в 1947 г. в том же институте была представлена к защите диссертация на тему "К теории периодического протекания гомогенных химических реакций", написанная И.Е. Сальниковым под научным руководством Франк-Каменецкого. Эта диссертация содержала обширную информацию о более чем вековой истории изучения химических колебаний и первые результаты по их теоретическому исследованию методами теории нелинейных колебаний, развиваемой школой академика Андронова. Но защита ее тогда не состоялась. По мнению Вольтера, "работы Франк-Каменецкого и Сальникова по химическим автоколебаниям, изложенные в диссертации, в книге и в ряде статей, безусловно, были новаторскими для тогдашней химической науки. Но это новаторство мало кто понимал. "Колебательная идеология" (термин Андронова) была чужда неколебательной обыденности химической науки и практики, и этим можно объяснить тот факт, что работы Франк-Каменецкого и Сальникова в 1940-е гг. были приняты в штыки, а когда состоялось вторичное открытие химических колебаний, их никто не вспомнил". Остается загадкой, имел ли представление об этих работах Белоусов. Во всяком случае, в его двух статьях не приводится ссылок на работы его предшественников.
Использованы материалы:
him.1september.ru, Википедия, журнал Природа, scholarpedia.org, hopf.chem.brandeis.edu, online.redwoods.cc.ca.us, vivovoco.rsl.ru.
Открытие колебательных
химических реакций
В 2001 г. исполнилось 50 лет открытию Б.П.Белоусовым автоколебательной химической реакции, благодаря которой появилась возможность наблюдать периодические изменения концентрации реагентов и распространение автоволн в гомогенной химической системе.
«Вы смотрите на стакан с красно-лиловой
жидкостью, а он вдруг становится ярко-синим. А
потом снова красно-лиловым. И снова синим. И вы
невольно начинаете дышать в такт колебаниям. А
когда жидкость налита тонким слоем, в ней
распространяются волны изменения окраски.
Образуются сложные узоры, круги, спирали, вихри,
или все приобретает совершенно хаотический вид»
– так описывает эту гомогенную колебательную
химическую реакцию профессор С.Э.Шноль,
сыгравший далеко не последнюю роль в спасении ее
от незаслуженного забвения.
В 1958 г. в Институте химической физики АН СССР
проходил семинар. Докладчик, молодой биофизик
Шноль, рассказывая о биоритмах, развивал свою
гипотезу, что биологическими часами управляют
химические реакции. Для подтверждения этого
нужны были реальные примеры химических
колебаний, и докладчик обратился к аудитории с
вопросом, не может ли кто-нибудь их указать. Таких
примеров никто не привел, более того, были
высказаны некоторые соображения о
принципиальной невозможности концентрационных
колебаний в химических реакциях. Вопрос
разрешился неожиданным образом. Уже после
закрытия семинара, когда почти все участники
разошлись, к докладчику подошел молодой аспирант
и сообщил, что химические колебания изучал его
дядя пять-шесть лет назад.
Такая непростая история
Выснилось, что Шноль давно искал этого
человека. Дядя, а точнее двоюродный дед аспиранта
Бориса Смирнова, Борис Павлович Белоусов еще в 1951
г. открыл колебания концентраций окисленной и
восстановленной форм церия в реакции
взаимодействия лимонной кислоты с броматом
калия, катализируемой ионами церия. Раствор
регулярно менял свою окраску от бесцветной к
желтой, обусловленной наличием церия(IV), затем
снова к бесцветной из-за церия(III) и т. д. Белоусов
провел достаточно подробное исследование этой
реакции и, в частности, выяснил, что период
колебаний существенно уменьшается с повышением
кислотности среды и температуры.
Реакция к тому же оказалась удобной для
лабораторных исследований. Колебания можно было
легко наблюдать визуально, а их период находился
в пределах 10–100 с.
Действительно, современная история исследований
колебательных химических реакций в жидкой фазе
началась в 1951 г. с открытия Белоусова, хотя для
самого автора все проходило далеко не так гладко.
Его статья с описанием колебательной реакции
дважды отклонялась редакциями академических
химических журналов. Лишь в 1958 г. ее сокращенный
вариант вышел в малоизвестном «Сборнике
рефератов по радиационной медицине».
Сейчас представляется, что основной причиной
неприятия химиками этого феномена послужило
широко распространенное мнение о том, что вдали
от положения равновесия концентрационные
колебания запрещены вторым законом
термодинамики.
В то время как химики, к которым присоединились и
биохимики, дружно отвергали химические
колебания, последние продолжали привлекать
внимание математиков и физиков,
интересовавшихся биологией. В 1952 г. появилась
статья английского ученого А.М.Тьюринга
«Химические основы морфогенеза», в которой он
сообщал, что сочетание химических колебаний с
диффузией молекул может приводить к появлению
устойчивых пространственных структур, области
высоких и низких концентраций которых
чередуются. Тьюринг поставил перед собой сугубо
теоретическую задачу: могут ли в реакторе в
условиях химической реакции образовываться
устойчивые конфигурации промежуточных
продуктов? И дал положительный ответ, создав
определенную математическую модель процесса.
Должного значения этой работе тогда не придали,
тем более что ни сам Тьюринг, ни его коллеги не
могли знать о работе Белоусова и его тщетных
попытках ее опубликовать.
В 1955 г. бельгийский физик и физикохимик, автор
теории термодинамики необратимых процессов,
И.Р.Пригожин показал, что в открытой системе
около стационарного состояния, достаточно
удаленного от химического равновесия, возможны
химические колебания. Именно он обратил внимание
западной научной общественности на работы
советских ученых. В результате некоторые
колебательные гетерогенные химические реакции,
открытые еще в конце XIX в., получили широкое
признание. Именно их стали рассматривать как
аналоги ряда периодических процессов, например
«биологических часов».
Исследователям стало ясно, что второй закон
термодинамики не нарушается в живых системах и
не мешает их сложному поведению и эволюции. Но
для существования жизни или любой ее физической
или химической модели необходимо, чтобы система
достаточно долго находилась вдали от
термодинамического равновесия. И гомогенные
химические системы могли стать удобной моделью
для изучения таких процессов.
Именно в это время профессор Шноль получил
«рецепт» колебательной реакции у Белоусова и
предложил ему сотрудничество, от которого тот
категорически отказался, хотя и не возражал
против продолжения этих работ.
В 1961 г. академик И.Е.Тамм, крупнейший
физик-теоретик, решил «проинспектировать»
состояние дел на недавно созданной кафедре
биофизики физического факультета МГУ. Шноль
продемонстрировал ему реакцию Белоусова. Вот как
рассказывает об этом сам Шноль: «Игорь
Евгеньевич увидел и надолго остановился,
наслаждался. Потом сказал: “Ну, знаете что,
братцы, имея такую реакцию, можете не
волноваться: на много лет хватит загадок и
работы”. Слова Игоря Евгеньевича подействовали
на многих. Реакцией решил заняться Толя
Жаботинский из первого нашего выпуска,
потомственный, как он сам про себя говорил,
физик».
Шноль поддержал молодого ученого и предложил
аспиранту А.М.Жаботинскому начать исследования
механизма реакции Белоусова, которыми тот с
энтузиазмом и занялся. «Замечательной
особенностью работ Жаботинского и
образовавшейся вокруг него группы сотрудников,
– вспоминает Шноль, – было сочетание
химического эксперимента, методов физической
регистрации и построение математических
моделей. В этих моделях – системах
дифференциальных уравнений – кинетические
константы подставлялись из экспериментальных
данных. После этого можно было сравнивать
экспериментальные записи колебаний с кривыми,
которые получались при компьютерном
моделировании».
Позже эти работы были продолжены в лаборатории
физической биохимии Института биологической
физики АН СССР. Вспоминает доктор
физико-математических наук В.А.Вавилин: «Перед
Жаботинским и мной, студентом-дипломником
кафедры биофизики физического факультета МГУ,
стояла задача обнаружить колебания в системе
Брея с помощью непрерывной
спектрофотометрической регистрации
концентрации йода. Интерес вызывало и сравнение
механизмов реакций Белоусова и Брея». Дело в том,
что колебания в жидкофазной химической системе
открыл в 1921 г. У.Брей. При разложении пероксида
водорода йодатом калия он обнаружил
периодическое выделение кислорода из системы,
зафиксировав несколько периодов сильно
затухающих колебаний. Некоторые исследователи,
ссылаясь на интенсивное газовыделение,
высказывали сомнения в гомогенном характере
этой реакции, поэтому существование
колебательной реакции именно в гомогенной среде
опыты Брея так и не доказали.
Между двумя периодическими реакциями Брея и
Белоусова сразу же возникла своего рода
«конкуренция». Тем не менее легкое
воспроизведение результатов и красивые
визуальные эффекты, наблюдаемые в реакции
Белоусова, способствовали появлению большого
числа ее приверженцев, и она получила широкую
известность (позднее ее назвали реакцией
Белоусова–Жаботинского, или БЖ-реакцией, а
периодическую реакцию Брея – реакцией
Брея–Либавского). По мнению Вавилина, открытие и
изучение в ходе реакции Белоусова автоколебаний
и автоволн С.Э.Шнолем, А.М.Жаботинским,
В.И.Кринским, А.Н.Заикиным, Г.Р.Иваницким – едва ли
не самая блестящая страница фундаментальной
отечественной науки в послевоенный период.
Кстати, Жаботинскому принадлежит одна из первых
книг в этой области.
Быстрое и успешное изучение реакции
Белоусова–Жаботинского сработало в науке как
спусковой крючок: сразу вспомнили, что и раньше
были известны процессы подобного рода. Однако
ценность реакции Белоусова, по мнению профессора
Б.В.Вольтера, кстати, впервые отметившего
значимость колебательных реакций и в
промышленных химико-технологических процессах,
состояла вовсе «не в приоритете, а в простоте и
наглядности эксперимента, наконец, в
результатах, полученных с помощью этого
интересного превращения А.М.Жаботинским,
А.Н.Заикиным, Е.Е.Сельковым и др.». Если же
обратиться к прошлому, то первые описания
колебаний в концентрационных системах относятся
к XIX в.
Исследования концентрационных
колебаний до открытия
реакции Белоусовым
Оказалось, что одна из первых публикаций по
химическим колебаниям относится к 1828 г. В ней
Т.Фехнер изложил результаты исследования
колебаний электрохимической реакции. В 1833 г.
В.Гершель публикует подобное исследование
колебаний каталитической гетерогенной реакции.
Наиболее интересна работа М.Розеншельда,
относящаяся к 1834 г. Ее автор совершенно случайно
заметил, что небольшая колба, содержащая немного
фосфора, в темноте испускает довольно
интенсивный свет. В самом факте свечения фосфора
не было ничего удивительного, но то, что это
свечение регулярно повторялось каждую седьмую
секунду, было интересно. В публикации
Розеншельда приводится детальное исследование
мерцаний колбы. Сорок лет спустя эти
эксперименты с «мерцающей колбой» продолжил
француз М.Жубер (1874). Ему удалось в пробирке
наблюдать периодическое образование
«светящихся облаков». Еще через двадцать лет
также немецкий ученый А.Центнершвер исследовал
влияние давления воздуха на периодические
вспышки фосфора. В его экспериментах период
вспышек начинался с 20 с и уменьшался с понижением
давления. В то же время в Англии химики Т.Торп и
А.Таттон наблюдали в запаянном стеклянном сосуде
периодические вспышки реакции окисления
триоксида фосфора.
Особенно яркая страница в истории химических
колебаний связана с так называемыми кольцами
Лизеганга. В 1896 г. немецкий химик Р.Лизеганг,
экспериментируя с фотохимикатами, обнаружил, что
если капнуть ляписом на стеклянную пластину,
покрытую желатиной, содержащей хромпик, то
продукт реакции, выпадая в осадок, располагается
на пластинке концентрическими окружностями.
Лизеганг увлекся этим явлением и почти полвека
занимался его исследованием. Нашлось и
практическое его применение. В прикладном
искусстве кольца Лизеганга использовали для
украшения различных изделий с имитацией яшмы,
малахита, агата и т. п. Сам Лизеганг предложил
технологию изготовления искусственного жемчуга.
И все-таки открытие Лизеганга, имевшее большой
резонанс в научных химических кругах, не было
первым. И до него изучали химические волны, а в 1855
г. вышла книга Ф.Рунге, в которой были собраны
многочисленные примеры таких экспериментов.
Перечень подобных примеров можно продолжить.
Вслед за указанными были открыты колебательные
реакции на границе раздела двух фаз. Из них
наиболее известны реакции на границе
металл–раствор, получившие специфические
названия – «железный нерв» и «ртутное сердце».
Первая из них – реакция растворения железа
(проволоки) в азотной кислоте – получила свое
название из-за внешнего сходства с динамикой
возбужденного нерва, замеченного В.Ф.Оствальдом.
Вторая, вернее один из ее вариантов, – реакция
разложения Н 2 О 2 на поверхности
металлической ртути. В реакции происходит
периодическое образование и растворение пленки
оксида на поверхности ртути. Колебания
поверхностного натяжения ртути обусловливают
ритмические пульсации капли, напоминающие
биение сердца. Но все эти реакции не привлекали
особенного внимания химиков, поскольку
представления о ходе химической реакции были еще
достаточно смутными.
Лишь во второй половине XIX в. возникли
термодинамика и химическая кинетика, положившие
начало специфическому интересу к колебательным
реакциям и методам их анализа. И в то же время
именно развитие равновесной термодинамики
послужило на первых порах тормозом при изучении
подобных процессов. Дело, видимо, было в «инерции
предыдущего знания». По словам профессора Шноля,
«не мог образованный человек представить себе в
беспорядочном тепловом движении огромного числа
молекул макроскопическую упорядоченность: все
молекулы то в одном, то в другом состоянии! Будто
признать существование вечного двигателя. Этого
быть не может. И в самом деле не может этого быть.
Не может быть вблизи состояния равновесия, а
только его и рассматривала термодинамика тех
лет. Однако никаких ограничений на сложные, в том
числе колебательные, режимы нет для
неравновесных химических систем, когда реакции
еще не завершились, и концентрации реагентов не
достигли равновесного уровня. Но это
обстоятельство ускользало от внимания химиков…
Потребовалось чрезвычайное интеллектуальное
напряжение, чтобы вырваться из “железных оков
полного знания” и исследовать поведение систем
вдали от равновесия».
Тем не менее уже в 1910 г. итальянец А.Лотка на
основе анализа системы дифференциальных
уравнений предсказал возможность колебаний в
химических системах. Однако первые
математические модели соответствовали только
затухающим колебаниям. Лишь через 10 лет Лотка
предложил систему с двумя последующими
автокаталитическими реакциями, и в этой модели
колебания уже могли быть незатухающими.
Однако позиции физиков и химиков здесь
разошлись. Одно из наиболее ярких достижений
физики и математики XX в. – создание теории
колебаний. Большие, общепризнанные заслуги
принадлежат здесь советским физикам. В 1928 г.
аспирант А.А.Андронов, будущий академик, выступил
на съезде физиков с докладом «Предельные циклы
Пуанкаре и теория автоколебаний».
В начале 1930-х гг. в Институте химической физики АН
СССР были обнаружены колебания свечения в
«холодных пламенах», аналогичные колебательной
люминесценции паров фосфора, которые
заинтересовали известного физика
Д.А.Франк-Каменецкого, объяснившего эти
колебания на основании кинетической модели
Лотки. А в 1947 г. в том же институте была
представлена к защите диссертация на тему «К
теории периодического протекания гомогенных
химических реакций», написанная И.Е.Сальниковым
под научным руководством Франк-Каменецкого. Эта
диссертация содержала обширную информацию о
более чем вековой истории изучения химических
колебаний и первые результаты по их
теоретическому исследованию методами теории
нелинейных колебаний, развиваемой школой
академика Андронова. Но защита ее тогда не
состоялась. По мнению Вольтера, «работы
Франк-Каменецкого и Сальникова по химическим
автоколебаниям, изложенные в диссертации, в
книге и в ряде статей, безусловно, были
новаторскими для тогдашней химической науки. Но
это новаторство мало кто понимал.
“Колебательная идеология” (термин Андронова)
была чужда неколебательной обыденности
химической науки и практики, и этим можно
объяснить тот факт, что работы Франк-Каменецкого
и Сальникова в 1940-е гг. были приняты в штыки, а
когда состоялось вторичное открытие химических
колебаний, их никто не вспомнил». Остается
загадкой, имел ли представление об этих работах
Белоусов. Во всяком случае, в его двух статьях не
приводится ссылок на работы его
предшественников.
Реакция Белоусова
и выяснение ее механизма
Вернемся к рассмотрению сути гомогенной
колебательной реакции. Белоусов использовал
лимонную кислоту, а в качестве пары
окислитель–восстановитель – производные церия.
Ученик и сотрудник Белоусова А.П.Сафронов
посоветовал добавить в раствор комплекс железа с
фенантронилом. В этой ситуации окраска эффектно
изменялась: с лилово-красной – в ярко-синюю.
Жаботинским, который занялся подробным
изучением механизма реакции, было окончательно
показано, что автоколебательная реакция может
осуществляться и в том случае, когда лимонная
кислота заменена любой другой дикарбоновой
кислотой с активной метиленовой группировкой, а
каталитическая редокс-пара Ce(IV)/Ce(III) заменена
парой Mn(III)/Mn(II) или, как уже использовалось
Белоусовым, парой ферроин/ферриин. Наиболее
изящно, эстетически зрелищно выглядела колба,
если использовали малоновую кислоту, а вместо
ионов церия ионы железа Fе2+. Тогда раствор в колбе
может часами со строгой периодичностью изменять
цвет во всем видимом диапазоне от
рубиново-красного до небесно-голубого.
Брутто-формула реакции выглядит достаточно
просто, однако реакция протекает более чем в 20
стадий и соответственно с образованием такого же
количества промежуточных продуктов. Рассмотрим
более подробно именно эту реакцию.
Для того чтобы ее осуществить, готовят два
раствора – А и Б.
А – раствор ферроина, комплекса железа(II) с о
-фенантролином
(phen) – 2+ :
Fe 2+ + 3phen = 2+ .
Раствор может быть приготовлен заранее.
Б – раствор броммалоновой кислоты (готовится
непосредственно перед демонстрацией):
Образующаяся броммалоновая кислота
неустойчива, однако некоторое время ее можно
хранить при низкой температуре.
Для непосредственной демонстрации опыта на
стеклянную пластинку, закрывающую световое окно,
ставят чашку Петри, в которую последовательно
вносят с помощью пипеток насыщенный раствор
бромата калия, раствор броммалоновой кислоты и
раствор ферроина. В течение нескольких минут на
красном фоне в чашке появляются голубые участки.
Это обусловлено образованием другого комплекса
ферриина 3+ при
окислительно-восстановительной реакции
комплекса ферроина 2+ с
бромат-ионами:
![]()
Этот процесс протекает с автоускорением. Затем образующийся комплекс 3+ окисляет броммалоновую кислоту с образованием бромид-ионов:
4 3+ + BrCH(COOH) 2 + 7H 2 O
=
4 2+ + 2CO 2 + 5H 3 O+ + Br – + HCOOH.
Выделяющиеся бромид-ионы являются
ингибиторами реакции окисления комплекса
железа(II) бромат-ионами. Только когда
концентрация 2+ становится
достаточно высокой, ингибирующее действие
бромид-ионов преодолевается, и снова начинают
протекать реакции получения броммалоновой
кислоты и окисления комплекса. Процесс
повторяется снова, и это отражается в окраске
раствора. От голубых участков в чашке во все
стороны расходятся концентрические круговые
красно-голубые «волны» окраски.
Если содержимое чашки перемешать стеклянной
палочкой, то раствор на непродолжительное время
станет одноцветным, а потом периодический
процесс повторится. В конце концов реакция
прекращается из-за выделения диоксида углерода.
Можно внести в чашку Петри помимо всех
перечисленных реагентов несколько кристалликов
гексагидрата нитрата церия(III), тогда диапазон
окрасок расширится: появится желтый цвет за счет
производных церия(IV) и зеленый из-за наложения
голубого и желтого цветов.
Математическое описание этих процессов
оказалось достаточно сложным. Оно привело к
неожиданным результатам. Выяснилось, что одна из
простейших химических схем, описывающих
колебания в системе двух последовательных
автокаталитических реакций, математически
тождественна уравнениям, которые итальянский
ученый В.Вольтерра в начале 1930-х гг. использовал
для описания экологических процессов. В
настоящее время это известная модель
Лотки–Вольтерры, которая описывает
периодические изменения численности «жертвы» и
«хищника» в экологических системах.
С.П.Муштакова, профессор Саратовского
государственного университета им.
Н.Г.Чернышевского, рассматривает колебательную
реакцию как взаимодействие двух систем, одна из
которых черпает необходимую ей для развития
энергию, вещество или другие компоненты из
другой. Такая задача называется задачей о
хищниках и жертвах.
Для наглядности представим, что в некоторой
ограниченной среде обитают волки и зайцы. В
данной экологической системе растет трава,
которой питаются зайцы, в свою очередь
являющиеся пищей для волков. Как известно, если
иметь любую совокупность живых существ, то при
благоприятных условиях их популяция будет
увеличиваться неограниченно. На самом деле
внешние факторы, например недостаток энергии или
пищи, такой процесс разрастания ограничивают.
Представим, что до определенного момента
взаимодействие двух подсистем, т. е. популяций
волков и зайцев, было сбалансированным: зайцев (с
учетом их естественного пополнения) как раз
хватало, чтобы прокормить определенное число
волков. Затем в момент, принимаемый за нуль
отсчета времени, из-за какой-то флуктуации число
зайцев возросло. Это увеличило количество пищи
для волков и, стало быть, их число. Возникла
флуктуация численности волков. Причем
количество волков и зайцев будет меняться во
времени периодически около некоторого среднего
(равновесного) значения. Сытые волки начинают
усиленно размножаться, давая новое потомство,
которое на обильной пище быстро взрослеет и дает
новый приплод. Складывается ситуация, когда
«зайчатник» уже не в состоянии прокормить всех
волков – численность зайцев начинает падать, а
волков (до поры) продолжает расти. Наконец
экосистема перенаселена волками, а зайцам место
чуть ли не в Красной книге. Но, став экологической
редкостью, зайцы становятся трудной добычей для
волков. Экосистема вступает в следующую фазу:
численность зайцев уже упала до минимального
уровня, при котором они практически неуловимы
для волков. Поголовье последних, пройдя через
максимум, начинает сокращаться, и это сокращение
продолжается до тех пор, пока не будет достигнут
такой его уровень, который в состоянии
прокормить зайцы при своей минимальной
численности. Теперь, когда численность волков
достигла минимума, некому охотиться и за зайцами.
Зайцы начинают плодиться, а скудному волчьему
поголовью за ними уже не уследить. Численность
зайцев в короткий срок достигнет уровня, при
котором они будут в состоянии прокормиться
травой. Вновь возникает изобилие зайцев.
Какие же выводы можно сделать из сопоставления
этого примера и колебательной реакции?
Отметим основные моменты, без которых описанный
колебательный процесс был бы невозможен.
Во-первых
, кооперативное поведение
молекул в растворе невозможно без обратной
связи. Смысл последней можно понять на примере
взаимодействия зайцев и волков: увеличение числа
особей хищника ведет к уменьшению популяции
жертв, и наоборот. Наличие такой обратной связи
обеспечивает устойчивое существование
экосистемы. Если описывать колебательные
химические реакции в терминах «хищник–жертва»,
то роль «хищников» выполняют промежуточные
продукты, которые замедляют или совсем блокируют
отдельные стадии процесса, – ингибиторы. Роль
«жертв» выполняют катализаторы, которые
ускоряют ход реакции. Хотя, как известно, сами
молекулы катализатора (Fе) не расходуются в
реакции, но соотношение концентраций ионов /,
как показали исследования, претерпевает сложную
эволюцию. Эта упрощенная схема позволяет в общих
чертах представить молекулярный механизм
обратной связи в растворе.
Во-вторых
, колебательный процесс
невозможен без источника энергии, роль которого
в модели Лотки–Вольтерры выполняла трава,
которую поедали зайцы. Очевидно, что ни о каких
колебаниях и тем более устойчивости цикла
«хищник–жертва» не может быть и речи, если в
заповеднике забетонировать всю территорию –
волки съедят зайцев и потом сами вымрут. В
реакции Белоусова–Жаботинского источником
энергии служит органическая малоновая кислота.
Действительно, при ее полном окислении колебания
в реакции затухают, а затем и сама реакция
прекращается.
К 1963 г. основной качественный этап изучения
реакции Белоусова был завершен. Ученый об этом
знал, но включаться в работу он так и не захотел. В
1966 г., в марте, был созван 1-й Всесоюзный симпозиум
по колебательным процессам в химии и биохимии.
Центральное место занимали доклады Жаботинского
и его соавторов – М.Д.Корзухина, В.А.Вавилина.
Белоусов от участия в симпозиуме отказался.
Значительно позже, в 1974 г., профессором химии и
биологии Аризонского университета (США)
А.Т.Уинфри были открыты
пространственно-временные структуры в
неперемешиваемой БЖ-системе, возникающие и
существующие в виде различных дву- и трехмерных
пространственных рисунков (например,
концентрических колец, спиралей, волновых
фронтов и т. п.). С тех пор интерес к таким системам
постоянно растет, указывая на перспективность
исследований в данном направлении.
Так, все больший удельный вес приобретают
исследования прикладной направленности,
например, в области моделирования
альтернативных средств обработки информации (в
частности, анализ сложных мозаик с градацией
яркости объектов). Еще одним новым направлением
прикладных исследований является изучение
особенностей полимеризации в БЖ-системе или
сходных с ней.
Сложной пространственно-временной организации,
проявляемой БЖ-системой в отсутствие
перемешивания, со временем нашлись аналогии в
природе, в биологических системах (например,
изучение фибрилляции сердечной мышцы с точки
зрения рассмотрения миокарда как
самоорганизующейся биологической системы).
К настоящему времени реакция
Белоусова–Жаботинского заняла достойное место
в мировой науке. Она фактически стимулировала
появление новой ее области – синергетики
(самоорганизации), а экспериментальные работы
инициировали развитие современной теории
динамических систем. Хотя в настоящее время
многое в таких реакциях уже понятно, однако
причины, вызывающие колебательные химические
процессы, остаются до конца невыясненными.
Динамическое описание колебательных химических
реакций может оказать в этом существенную
помощь, в частности косвенным путем установить
недостающие константы скоростей реакций.
Фундаментальные изменения в естествознании,
породившие так называемую теорию
самоорганизации, обусловлены в значительной
степени начальным импульсом, приданным ей
российскими учеными на рубеже 1950–1960-х гг., когда
Белоусов открыл окислительно-восстановительную
химическую реакцию. При этом были обнаружены
поразительные аналогии, оказалось, что многие
природные явления, начиная от образования
галактик до смерчей, циклонов и игры света на
отражающих поверхностях, по сути дела, –
процессы самоорганизации. Они могут иметь самую
различную природу: химическую, механическую,
оптическую, электрическую и др.
В настоящее время кинетика колебательных
реакций – бурно развивающаяся отрасль знаний,
возникшая на стыке химии, биологии, медицины,
физики, математики.
ЛИТЕРАТУРА
Вольтер Б.В.
Легенда и быль о химических
колебаниях. Знание – сила, 1988, № 4, с. 33–37; Жаботинский
А.М.
Концентрационные колебания. М.: Наука, 1974,
179 с.;
Шноль С.Э.
Герои, злодеи, конформисты
российской науки. М.: Крон-Пресс, 2001, 875 с.;
Муштакова С.П.
Колебательные реакции в
химии. Соросовский образовательный журнал, 1997,
№ 7, с. 31–37;
Вавилин В.А.
Автоколебания в жидкофазных
химических системах. Природа, 2000, № 5, с. 19–25.
БЕЛОУСОВ Борис Павлович (19.II.1893–12.VI.1970) – советский химик. Родился в Москве в семье банковского служащего, шестой ребенок в семье. Вместе с братьями рано был вовлечен в революционную деятельность и в возрасте 12 лет арестован. Его матери предложили на выбор: либо сибирская ссылка, либо эмиграция. Семья оказалась в Швейцарии в большевистской колонии. Будущему ученому довелось играть в шахматы с В.И.Лениным. Борис удивлялся его азарту, тому, как он всячески поносит своего противника, пытаясь его деморализовать. На этом для Белоусова революционно-политическая деятельность закончилась. В партию он так и не вступил. В Цюрихе началось его увлечение химией, но возможности получить образование не было, поскольку надо было платить за обучение. В начале первой мировой войны Борис вернулся в Россию, желая добровольно вступить в армию, но по состоянию здоровья его не взяли.
Белоусов поступает на работу в химическую лабораторию металлургического завода Гужона (ныне завод «Серп и молот»). Лабораторию эту идейно возглавлял В.Н.Ипатьев, что предопределило направление исследований будущего ученого: разработка способов борьбы с отравляющими веществами, составы для противогазов.
Став военным химиком, Белоусов с 1923 г. по рекомендации академика П.П.Лазарева преподает химию командирам Красной Армии в Высшей военно-химической школе РККА (Рабоче-крестьянская Красная Армия, 1918–1946), читает курс лекций по общей и специальной химии в школе усовершенствования командного состава РККА. В 1933 г. Белоусов – старший преподаватель Военной Краснознаменной академии химической защиты имени С.К.Тимошенко.
Специфика научной деятельности Белоусова была такова, что ни один из его научных трудов никогда и нигде не был опубликован. Академик А.Н.Теренин назвал Белоусова выдающимся химиком. В его отзыве, написанном в связи с возможностью присуждения Белоусову докторской степени без защиты диссертации, отмечается, что «Б.П.Белоусовым начато совершенно новое направление газового анализа, заключающееся в изменении цвета пленочных гелей при сорбции ими активных газов. Задача заключалась в создании специфических и универсальных индикаторов на вредные газообразные соединения с обнаружением их в исключительно малых концентрациях. Эта задача была блестяще выполнена… был разработан ряд оптических приборов, позволяющих автоматически или полуавтоматически производить качественный анализ воздуха на вредные газы… В этой группе работ Б.П.Белоусов проявил себя как ученый, по-новому ставящий проблему и решающий ее совершенно оригинальным путем. Помимо этих исследований Б.П.Белоусову принадлежит ряд столь же оригинальных и интересных научных работ, которые не оставляют сомнения в том, что он безусловно заслуживает присуждения ему степени доктора химических наук без защиты диссертации». Непростой характер Бориса Павловича проявился и здесь, он «не хотел никаких дипломов».
Тем не менее военному химику Белоусову было присвоено звание комбрига, эквивалентное званию генерал-майора. Правда, в 1935 г. он уходит в долгосрочный отпуск, а в 1938 г. подает в отставку. Этим, возможно, объясняется то, что сам Белоусов не пострадал в период массовых репрессий 1937–1938 гг. Однако потеря многих сослуживцев и друзей наложила неизгладимый отпечаток на его характер. Неизвестно точное название секретного медицинского института, в котором работал в последующие годы Белоусов. Но, по словам сослуживцев, у него были замечательные открытия в области создания препаратов, снижающих влияние радиации, его ценили: не имея все-таки высшего образования, ученый заведовал лабораторией и по письменному указанию И.В.Сталина получал оклад доктора наук.
Проанализировав циклические реакции, открытые в послевоенные годы биохимиками, Белоусов решил осуществить химическую аналогию биологических циклов. Исследуя окисление лимонной кислоты броматом в присутствии катализатора, он обнаружил концентрационые колебания реагентов – так была открыта колебательная реакция. В 1951 г. и 1955 г. Белоусов предпринимает попытки опубликовать свое открытие в журналах «Кинетика и катализ» и «Журнал общей химии»». Отзывы на его статьи были категорично отрицательные и, как потом выяснилось, столь же категорично ошибочными. Известно, что это так повлияло на ученого, что он просто выбросил лабораторную пропись реакции и забыл о ней.
Через несколько лет, когда биохимики заинтересовались открытой Белоусовым реакцией, ему пришлось искать исходные компоненты и их пропорции путем последовательного перебора. Можно сказать, что открытие было сделано Белоусовым дважды – первый раз случайно, второй раз в результате системного поиска. Но активно участвовать в работе научного коллектива он больше не хотел. Все, что удалось коллегам, это уговорить Белоусова еще раз попытаться опубликовать свою статью. В результате единственная прижизненная публикация ученого появилась в «Сборнике рефератов по радиационной медицине» за 1958 г.
Но и когда пришло признание и международное научное сообщество назвало колебательную реакцию именем Белоусова–Жаботинского, попытки привлечь отставного комбрига к ее дальнейшему изучению были безуспешными. Те, кто его знал в последние годы, утверждали, что творческая активность Белоусова оставалась очень высокой. Он покинул институт незадолго до своей смерти – 12 июня 1970 г. До присуждения Белоусову Ленинской премии оставалось 10 лет.